Pytania i odpowiedzi
Enzymy real
Zebrane pytania i odpowiedzi do zestawu.
Ilość pytań: 35
Rozwiązywany: 945 razy
Pytanie 1
Badając wpływ inhibitora na kinetykę reakcji enzymatycznej zaobserwowano wzrost Km bez zmiany V max. Było to wynikiem hamowania:
kompetecyjnego
Pytanie 2
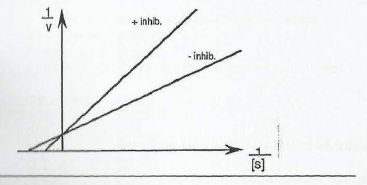
Wskaż prawdziwe informacje dotyczące inhibitora, którego działanie przedstawiono na wykresie:
1, jego działanie może być cofnięte przez zwiększenie stężenia substratu
2. zmniejsza powinowactwo enzymu do substratu
3. może nim być analog strukturalny substratu
4. stężenie substratu nie wpływa na jego działanie
1,2,3
Pytanie 3
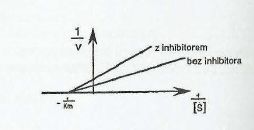
Na podstawie przedstawionego wykresu można stwierdzić, że:
zastosowanym inhibitorem mógł być czynnik chejatujący (np. EDTA)
2. inhibitor mógł łączyć się z kompleksem ES
3. zwiększenie stężenia substratu nie cofnie działania inhibitora
4. działanie inhibitora zwiększyło V max reakcji enzymatycznej
1,2,3
Pytanie 4
Wskaż prawdziwe informacje dotyczące enzymów:
1. nie zmieniają stanu równowagi reakcji
2. koenzymy odpowiadają za swoistość substratową enzymów
3. mogą występować w formie izoenzymów
4. są katalizatorami biologicznymi i zużywają się podczas reakcji
1,3
Pytanie 5
Przy powstawaniu kompleksu enzym-substrat nie biorą udziału następujące wiązania:
1. wiązania jonowe
2. wiązania wodorowe
3. oddziaływania hydrofobowe
4. wiązania disiarczkowe
4
Pytanie 6
W przypadku hamowania enzymu przez inhibitor kompetycyjny:
1. powinowactwo enzymu do substratu maleje
2. Vmax reakcji maleje
3. wartość Krn rośnie
4. inhibitor przyłącza się do miejsca regulatorowego
1,3
Pytanie 7
Które z podanych informacji o hamowaniu niekompetycyjnym są prawdziwe:
1. nie można go cofnąć poprzez zwiększenie stężenia substratu
2. między substratem a inhibitorem nie ma współzawodnictwa o centrum aktywne enzymu
3. do inhibitorów niekompetycyjnych należą np. sole metali ciężkich i EDTA
4. wartość Km w obecności inhibitora niekompetecyjnego rośnie natomiast V max pozostaje bez zmian
1,2,3
Pytanie 8
Malonian jest inhibitorem kompetycyjnym dehydrogenazy bursztynianowej ponieważ:
1. wiąże substrat tego enzymu
2. przyłącza się w miejscu allosterycznym enzymu zmieniając jego powinowactwo do substratu
3. przesuwa równowagę reakcji enzymatycznej w stronę tworzenia bursztynianu
4. jest analogiem strukturalnym substratu
4
Pytanie 9
Wybierz prawdziwe informacje dotyczące oznaczania aktywności
enzymów:
1. oznaczenie aktywności enzymu polega na pomiarze ubytku
stężenia substratu lub przyrostu stężenia produktu reakcji
w określonym czasie
2. oznaczenie aktywności enzymu przeprowadzane jest
w warunkach optymalnego pH i temperatury
3. aktywność właściwa enzymu jest to liczba jednostek
enzymatycznych na 1 mg białka i jest miarą czystości preparatu
enzymatycznego
4. oznaczanie aktywności enzymatycznej polega na określeniu
stężenia enzymu
1,2,3
Pytanie 10
Które z twierdzeń dotyczących allosterii jest nieprawdziwe:
jest rodzajem izomerii
Pytanie 11
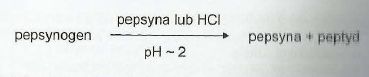
Jaki rodzaj regulacji aktywności enzymatycznej ilustruje poniższa reakcja:
1. modyfikacji kowalencyjnej
2. regulacji przez sprzężenie zwrotne
3. regulacji allosterycznej
4. ograniczonej proteolizy
4
Pytanie 12
Działanie jonów metali jako aktywatorów enzymatycznych może polegać na:
1. ułatwieniu powstawania kompleksu E-S
2. działaniu jako dodatnie efektory allosteryczne
3. utrzymaniu IV-rzędowej struktury białka
4. przenoszeniu elektronów w procesach oksydoredukcyjnych
1,2,3,4
Pytanie 13
Regulacja aktywności enzymów może zachodzić na drodze:
1. sprzężenia zwrotnego dodatniego i ujemnego
2. ograniczonej proteolizy białka enzymatycznego
3. fosforylacji i defosforylacji białka enzymatycznego
4. regulacji allosterycznej
1,2,3,4
Pytanie 14
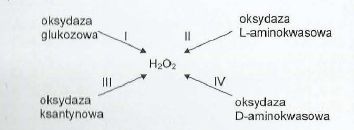
Grupą prostetyczną wymienionych poniżej oksydaz (I-IV) jest pochodna witaminy:
B2
Pytanie 15
Koenzymem przenoszącym atomy wodoru jest:
kwas liponowy
Pytanie 16
Wybierz zestaw, w którym każdy z koenzymów (I-IV) jest dobrany do właściwej reakcji (1-4):
I. witamina B12
II fosforan pirydoksalu
III FAD
IV CoA
1 dekarboksylacja aminokwasów
2. utlenianie bursztynianu
3. synteza bursztynylo-CoA
4. procesy acetylacji
I-3, II-1, III-2, IV-4
Pytanie 17
Hydroksylazy:
1. należą do grupy oksydoreduktaz
2. są enzymami przyłączającymi tlen do substratu
3. wymagają współdziałania tlenu oraz czynnika redukcyjnego np. NADPH+ W
4. biorą udział w II fazie detoksykacji ksenobiotyków
1,2,3
Pytanie 18
Fosforan pirydoksalu nie bierze udziału w syntezie:
glikogenu
Pytanie 19
Które z podanych niżej enzymów mają zdolność przenoszenia równoważników redukcyjnych bezpośrednio na ubichinon:
1. dehydrogenaza jabłczanowa
2. dehydrogenaza acylo-CoA
3. dehydrogenaza glutaminianowa
4. dehydrogenaza bursztynianowa
4
Pytanie 20
Które z przedstawionych definicji reakcji enzymatycznych dotyczą monooksygenaz:
1. Przenoszą elektrony na różne związki poza tlenem
2. wprowadzają jeden z dwóch atomów tlenu do substratu, a drugi atom tlenu ulega redukcji do wody
3. przenoszą elektrony na tlen cząsteczkowy
4. są sprzężone z mikrosomalnym łańcuchem przenoszenia elektronów i wymagają do swojego działania tlenu i NADPH+ H+
2,4


